磷
body.skin-minerva .mw-parser-output table.infobox caption{text-align:center}
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 外觀 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
無色、蠟狀白、黃、深紅、紅、紫或黑  由左而右分別是:蠟狀白磷(黃色切面), 顆粒狀紅磷,塊狀紅磷、紫磷 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 概況 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 名稱·符號·序數 | 磷(phosphorus)·P·15 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 元素類別 | 非金屬 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
族·週期·區 | 15 ·3·p | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 標準原子質量 | 30.973762(2) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 電子排布 | [氖] 3s2 3p3  | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 歷史 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 發現 | 亨尼格·布蘭德(1669年) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 確認其為一元素者 | 安東萬·拉瓦節[1] (1777) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 物理性質 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 物態 | 固態 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 密度 | (接近室温) (白磷) 1.823, (紅磷) ≈ 2.2 – 2.34, (紫磷) 2.36, (黑磷) 2.69 g·cm−3 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 熔點 | (白磷) 44.2 °C, (黑磷) 610 °C | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 昇華點 | (紅磷) ≈ 416 – 590 °C, (紫磷) 620 °C | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 沸點 | (白磷) 280.5 °C | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 熔化熱 | (白磷) 0.66 kJ·mol−1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 汽化熱 | (白磷) 12.4 kJ·mol−1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 比熱容 | (白磷) 23.824 J·mol−1·K−1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
蒸氣壓((白磷))
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 蒸氣壓((紅磷, 沸點 431 °C)) |
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 原子性質 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 氧化態 | 5, 4, 3, 2[2], 1[3], −1, −2, −3 (弱酸性氧化物) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 電負性 | 2.19(鲍林标度) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 電離能 | 第一:1011.8 kJ·mol−1 (更多) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 范德華半徑 | 180 pm | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 雜項 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 晶體結構 | 体心立方 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 磁序 | (白,紅,紫,黑) 抗磁性[4] | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 熱導率 | (白磷) 0.236, (黑磷) 12.1 W·m−1·K−1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 體積模量 | (白磷) 5, (紅磷) 11 GPa | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| CAS號 | 7723-14-0 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 最穩定同位素 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
主条目:磷的同位素
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
磷(拉丁語:Phosphorum,化学符号:P)[5]是一种化学元素,它的原子序数是15。
目录
1 性状
1.1 单质磷的同素异構体
2 化学性质
3 发现
4 名称由来
5 分布
6 制备
7 同位素
8 化合物
8.1 含氧酸
8.2 磷(V)化合物
8.2.1 含氧化合物
8.2.2 含硫化合物
9 用途
10 对人体的影响
11 参考文献
性状
磷是一种易起化学反应的、有毒的氮族非金属元素。它的化学反应活性和毒性取决于形态不同而有所区别。
磷化氫燃烧的火叫鬼火。
单质磷的同素异構体
黑磷(金属磷)
- 化學結構類似石墨,因此可導電。
- 化學式一般寫為P{displaystyle {ce {P}}}。
- 深黑色粉末
白磷(黃磷)
- 化學式:P4{displaystyle {{ce {P4}}}}
- 淡黃蠟似半透明可結晶的固體,於黑暗中能發光。放置一段時間部份表面白磷會形成紅磷,使白磷變成淡黃色。不溶於水,但可溶於苯、乙醚,需保存於水中。有特臭,劇毒。比重1.83,熔點44.4,沸點287度。可作武器白磷彈,吸入人體會燃燒形成磷酸酐,造成呼吸道及肺部灼傷,磷酸酐溶於水形成磷酸,具強脫水性,使呼吸道及肺部脫水。
- 在溫度35℃以上會在大氣中自燃,與氧氣産生P2O5{displaystyle {ce {P2O5}}} ,必須保存在水中。P2O5{displaystyle {ce {P2O5}}}當被吸入時會與肺裏水分形成磷酸並產生大量熱能使肺部灼傷。
- 化學式:P4{displaystyle {{ce {P4}}}}
红磷(赤磷)
- 化學結構為巨型共價分子。
- 化學式一般寫為P{displaystyle {ce {P}}}。
- 鮮紅色粉末,無毒,比重2.296,熔點725度,是黃磷於壓力下稀有气体中加熱8-10日而成,白磷隔除空氣加熱至250度可得紅磷。
紫磷
- 化學結構為層狀,但與黑磷不同。
- 化學式一般寫為P{displaystyle {ce {P}}}。
化学性质
 播放媒体
播放媒体把白磷溶於二硫化碳,再把溶液灑在紙上。二硫化碳揮發後留下白磷,白磷在空氣中自燃,令紙張燒焦。
磷可以在空气中燃烧,生成大量十氧化四磷
白烟:
4P+5O2⟶2P2O5{displaystyle {ce {4P + 5O2 -> 2P2O5}}}
在有催化剂存在的情况下,白磷、红磷和水经过几步反应生成H3PO4、H2及很少量的H3PO3和PH3:
P4+16H2O=4H3PO4+10H2{displaystyle {ce {P4 + 16H2O = 4H3PO4 + 10H2}}}[6]
发现
在化学史上第一个发现磷元素的人,当推十七世纪的一个德国汉堡商人波兰特(Henning Brand,约1630年~约1710年)。他是一个相信炼金术的人,由于他曾听传说从尿里可以制得“金属之王”黄金,于是抱着图谋发财的目的,便用尿作了大量实验。1669年,他在一次实验中,将砂、木炭、石灰等和尿混合,加热蒸馏,虽没有得到黄金,而竟意外地得到一种十分美丽的物质,它色白质软,能在黑暗的地方放出闪烁的亮光,于是波兰特给它取了个名字,叫“冷光”,这就是今日称之为白磷的物质。波兰特对制磷之法,起初极守秘密,不过,他发现这种新物质的消息立刻传遍了德国。
德国化学家孔克爾曾用尽种种方法想打听出这一秘密的制法,终于探知这种所谓发光的物质,是由尿里提取出来的,于是他也开始用尿做试验,经过苦心摸索,终于在1678年也告成功。他是把新鲜的尿蒸馏,待蒸到水分快干时,取出黑色残渣,放置在地窑里,使它腐烂,经过数日后,他将黑色残渣取出,与两倍于“尿渣”重的细砂混合。一起放置在曲颈瓶中,加热蒸馏,瓶颈则接连盛水的收容器。起初用微火加热,继用大火干馏,及至尿中的挥发性物质完全蒸发后,磷就在收容器中凝结成为白色蜡状的固体。后来,他为介绍磷,曾写过一本书,名叫《论奇异的磷质及其发光丸》。
在磷元素的发现上,英国化学家罗伯特·波义耳差不多与孔克尔同时,用与他相近的方法也制得了磷。波义耳的学生汉克维茨(Codfrey Hanckwitz)曾用这种方法在英国制得较大量的磷,作为商品运到欧洲其他国家出售。他在1733年曾发表论文,介绍制磷的方法,不过说得十分含糊,以后,又有人从动物骨质中发现了磷。
名称由来
由于单质磷在空气中会自燃或缓慢氧化而放热发光,因此磷的拉丁文名称Phosphorum来源于希腊文Φωσφόρος的拉丁化,原指“启明星”,意为“光亮”。
而在中文裡,磷的本字為粦,根據晋代《博物志》記載,「戰鬬死亡之處,有人馬血,積中爲粦,著地入艸木,如霜露不可見。有觸者,著人體後有光,拂拭即散無數,又有吒聲如鬻豆。舛者,人足也。言光行著人。」可見上部"米"字乃代表鬼火之"炎"字轉寫,下部"舛"字則指人足部。
“磷”字本与“粦”无关,如司馬相如在作賦時將其與"嶙"、"粼"混用,指光亮。南朝时期的字典《玉篇》中記載為雲母之意。本作为鬼火之源的"粦"後加石字偏旁以作為其元素性質之辨,指鬼火之源所含的元素。此與"磷"之原來諸義皆有所不同。
分布
磷在地壳中的含量为0.09%。磷不以单质存在,通常在磷酸盐中天然存在,尤其是磷灰石。磷也存在于生物体当中,是原生质的基本成分。
制备
磷的现代制法是将磷酸钙与砂(主要成分为二氧化硅)及焦炭一起放在电炉中加热。为使反应式易于理解,可写成两步如下:
- Ca3(PO4)2+3SiO2⟶3CaSiO3+P2O5{displaystyle {ce {Ca3(PO4)2 + 3SiO2 -> 3CaSiO3 + P2O5}}}
- P2O5+5C⟶2P+5CO{displaystyle {ce {P2O5 + 5C -> 2P + 5CO}}}
同位素
已发现磷的同位素共有13种,包括磷27至磷39,其中只有磷31是稳定的,其他同位素都带有放射性。
化合物
含氧酸
磷的含氧酸非常丰富,结构较为复杂,且大多具有商业价值。这些含氧酸都有和氧相连的氢原子,可以体现酸性,也有些有不体现酸性的直接连在磷上的氢原子。纵然许多磷的含氧酸已经被合成,但仅有以下几种是较常见的。其中的三种——次磷酸、亚磷酸和磷酸尤为重要。
| 名称 | 化学式 | 磷的氧化数(化合价) | 结构式 | N元酸 | 化合物形态 |
|---|---|---|---|---|---|
| 次磷酸 | H3PO2{displaystyle {ce {H3PO2}}} | +1 |  | 1 | 酸、盐 |
| 亚磷酸 | H3PO3{displaystyle {ce {H3PO3}}} | +3 |  | 2 | 酸、盐 |
| 偏亚磷酸 | HPO2{displaystyle {ce {HPO2}}} | +3 |  | 1 | 盐 |
原亚磷酸(与亚磷酸为互变异构体) | H3PO3{displaystyle {ce {H3PO3}}} | +3 |  | 3 | 酸、盐 |
| 连二磷酸 | H4P2O6{displaystyle {ce {H4P2O6}}} | +4 | 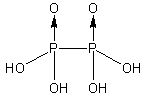 | 4 | 酸、盐 |
| n(聚)偏磷酸 | (HPO2)n{displaystyle {ce {(HPO2)_{n}}}} | +5 |  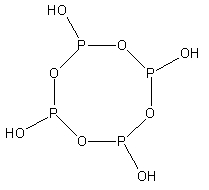 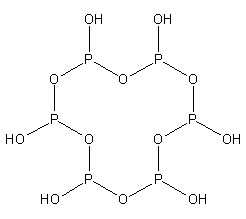 | n | 盐(n=3、4、6) |
| 磷酸(正磷酸) | H3PO4{displaystyle {{ce {H3PO4}}}} | +5 |  (n聚磷酸n=1时) (n聚磷酸n=1时) | 3 | 酸、盐 |
| n(聚)磷酸 | H(HPO3)nOH{displaystyle {ce {H(HPO3)_{n}OH}}} | +5 | 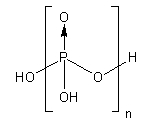 | n+2 | 酸、盐(n=1-6) |
| 焦磷酸 | H4P2O7{displaystyle {ce {H4P2O7}}} | +5 | 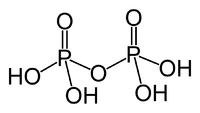 (n聚磷酸n=2时) (n聚磷酸n=2时) | 4 | 酸、盐 |
| 三磷酸 | H5P3O10{displaystyle {ce {H5P3O10}}} | +5 | 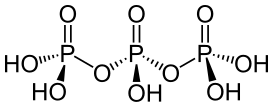 (n聚磷酸n=3时) (n聚磷酸n=3时) | 5 | 盐 |
磷(V)化合物
含氧化合物
最常见的磷化合物是磷酸盐(PO43−{displaystyle {ce {PO4^3-}}}),它是一个呈四面体的阴离子。[7]其一个很重要的作用是用作化肥。磷酸根离子是(正)磷酸的共轭碱。磷酸是一个三元酸,所以它可以逐步转变为以下三种共轭碱:
H3PO4+H2O↽−−⇀H3O++H2PO4−{displaystyle {ce {H3PO4 + H2O <=> H3O+ + {H2PO4}^{-}}}} Ka1= 7.25×10−3
H2PO4−+H2O↽−−⇀H3O++HPO42−{displaystyle {ce {{H2PO4}^{-}+ H2O <=> H3O+ + {HPO4}^{2-}}}} Ka2= 6.31×10−8
HPO42−+H2O↽−−⇀H3O++PO43−{displaystyle {ce {{HPO4}^{2-}+ H2O <=> {H3O}^{+}+ {PO4}^{3-}}}} Ka3= 3.98×10−13
磷酸及其衍生物有聚合成链或环而形成P−O−P{displaystyle {ce {P-O-P}}}键的倾向。目前已知的聚磷酸衍生物已经有很多,比如ATP。它们通过磷酸氢盐(例如HPO42−{displaystyle {ce {{HPO4}^{2-}}}}和H2PO42−{displaystyle {ce {{H2PO4}^{2-}}}})脱水得到。例如,下列缩合反应在工业上非常广泛地用于生产三磷酸钠(俗称五钠):
- 2Na2[(HO)PO3]+Na[(HO)2PO2]⟶Na5[O3P−O−P(O)2−O−PO3]+2H2O{displaystyle {ce {2Na2[(HO)PO3] + Na[(HO)2PO2] -> Na5[O3P-O-P(O)2-O-PO3] + 2H2O}}}
十氧化四磷(P4O10)是磷酸的酸酐。它是白色的固体,与水反应非常剧烈。
PCl5{displaystyle {ce {PCl5}}}和PF5{displaystyle {ce {PF5}}}两种化合物具有共同点:它们都较不稳定,且都是白色或浅色的。PCl5{displaystyle {ce {PCl5}}}和PF5{displaystyle {ce {PF5}}}的空间构型都是五角双锥,并且它们都是路易斯酸。后者可以形成PF6−{displaystyle {ce {{PF6}^{-}}}}离子,它和SF6{displaystyle {ce {SF6}}}互为等电子体。至于另外两种磷的卤化物PBr5{displaystyle {ce {PBr5}}}和PI5{displaystyle {ce {PI5}}}都是极不稳定的。而磷最主要的卤氧化物是三氯氧磷(POCl3{displaystyle {{ce {POCl3}}}}),它的空间构型是四面体型的。
以往一直认为磷(V)化合物中磷的d轨道参与了杂化。然而经过计算机大量计算,事实并非如此:磷只用了s和p轨道杂化[8]。这可用分子轨道理论来解释。
含硫化合物
磷酸根中的氧可以被硫取代,如硫代磷酸。
多种硫化磷也是已知的。
用途
磷可用于安全火柴、烟花、燃烧弹和化肥,还可以保护金属表面免于腐蚀。
磷酸的用途也十分广泛。
对人体的影响
磷是骨骼和牙齿的构成材料之一。正常成年人骨中的含磷总量约为600~900克,人体每100毫升全血中含磷35-45毫克。磷能保持人体内代谢平衡,在调节能量代谢过程中发挥重要作用。它是生命物质核苷酸的基本成分。它参与体内的酸碱平衡的调节,参与体内脂肪的代谢。
磷缺乏可以出现低磷血症,引起红细胞、白细胞、血小板的异常,软骨病。磷过多将导致高磷血症,使血液中血钙降低导致骨质疏松。
短时间内摄取一定分量的白磷单质,可造成急性白磷中毒。
参考文献
^ cf. "Memoir on Combustion in General" Mémoires de l'Académie Royale des Sciences 1777, 592–600. from Henry Marshall Leicester and Herbert S. Klickstein, A Source Book in Chemistry 1400–1900 (New York: McGraw Hill, 1952)
^ webelements
^ Ellis, Bobby D.; MacDonald, Charles L. B. Phosphorus(I) Iodide: A Versatile Metathesis Reagent for the Synthesis of Low Oxidation State Phosphorus Compounds. Inorganic Chemistry. 2006, 45 (17): 6864–74. PMID 16903744. doi:10.1021/ic060186o.
^ Magnetic susceptibility of the elements and inorganic compounds 互联网档案馆的存檔,存档日期2012-01-12., in Lide, D. R. (编), CRC Handbook of Chemistry and Physics 86th, Boca Raton (FL): CRC Press, 2005, ISBN 0-8493-0486-5
^ 夏征农、陈至立 (编). 《辞海》第六版彩图本. 上海: 上海辞书出版社. 2009年: 第3227页. ISBN 9787532628599.
^ 无机化学丛书.第四卷.P195.张青莲 主编
^ D. E. C. Corbridge "Phosphorus: An Outline of its Chemistry, Biochemistry, and Technology" 5th Edition Elsevier:
Amsterdam 1995. ISBN 978-0-444-89307-9.
^ Kutzelnigg, W. Chemical Bonding in Higher Main Group Elements (PDF). Angewandte Chemie Int. (English) Ed. 1984, 23 (4): 272–295. doi:10.1002/anie.198402721.
氮族元素 | ||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| | IA 1 | IIA 2 | IIIB 3 | IVB 4 | VB 5 | VIB 6 | VIIB 7 | VIIIB 8 | VIIIB 9 | VIIIB 10 | IB 11 | IIB 12 | IIIA 13 | IVA 14 | VA 15 | VIA 16 | VIIA 17 | VIIIA 18 | ||||||||||||||||||
1 | H | | He | |||||||||||||||||||||||||||||||||
2 | Li | Be | | B | C | N | O | F | Ne | |||||||||||||||||||||||||||
3 | Na | Mg | | Al | Si | P | S | Cl | Ar | |||||||||||||||||||||||||||
4 | K | Ca | | Sc | Ti | V | Cr | Mn | Fe | Co | Ni | Cu | Zn | Ga | Ge | As | Se | Br | Kr | |||||||||||||||||
5 | Rb | Sr | | Y | Zr | Nb | Mo | Tc | Ru | Rh | Pd | Ag | Cd | In | Sn | Sb | Te | I | Xe | |||||||||||||||||
6 | Cs | Ba | La | Ce | Pr | Nd | Pm | Sm | Eu | Gd | Tb | Dy | Ho | Er | Tm | Yb | Lu | Hf | Ta | W | Re | Os | Ir | Pt | Au | Hg | Tl | Pb | Bi | Po | At | Rn | ||||
7 | Fr | Ra | Ac | Th | Pa | U | Np | Pu | Am | Cm | Bk | Cf | Es | Fm | Md | No | Lr | Rf | Db | Sg | Bh | Hs | Mt | Ds | Rg | Cn | Nh | Fl | Mc | Lv | Ts | Og | ||||
| ||||||||||||||||||||||||||||||||||||
|























![{displaystyle {ce {2Na2[(HO)PO3] + Na[(HO)2PO2] -> Na5[O3P-O-P(O)2-O-PO3] + 2H2O}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/52711a40d6a0e31fd31153f5630d880711fce8ab)






