1,5-环辛二烯
| 1,5-环辛二烯 | |
|---|---|
 | |
 | |
| 识别 | |
CAS号 | 111-78-4 |
ChemSpider | 74815 |
SMILES |
|
InChI |
|
InChIKey | VYXHVRARDIDEHS-QGTKBVGQBM |
EC编号 | 203-907-1 |
| 性质 | |
化学式 | C8H12 |
摩尔质量 | 108.18 g·mol−1 |
| 外观 | 澄清无色液体 |
密度 | 0.882 g cm−3(液态) |
熔点 | -69.5 °C(204 K) |
沸点 | 151 °C(424 K) |
溶解性(水) | - |
| 若非注明,所有数据均出自一般条件(25 ℃,100 kPa)下。 | |
1,5-环辛二烯是一种有机化合物,化学式为C8H12,通常可以简写成COD。这种二烯烃是制备其他有机物的重要前体,并在金属有机化学用作配体。[1][2]
目录
1 合成
2 有机反应
3 金属配合物
4 (E,E)-COD
5 参考文献
合成
1,5-环辛二烯可由1,3-丁二烯在镍催化剂作用下二聚制得,同时得到的副产物还有乙烯基环己烯。2005年时全球大约生产了10,000吨1,5-环辛二烯。[3]
有机反应
1,5-环辛二烯与乙硼烷二甲基硫醚加合物(相当于甲硼烷)反应产生9-硼二环[3.3.1]壬烷,[4] 后者简称9-BBN,是有机化学中用于硼氢化反应的试剂:
1,5-环辛二烯与二氯化硫或类似试剂加成得到2,6-二氯代-9-硫代双环[3.3.1]壬烷:[5]
得益于邻基参与效应,产生的二氯代物可以通过亲核取代反应生成二叠氮基或二氰基衍生物。
1,5-环辛二烯在五羰基铁的存在下可以发生异构化反应,反应完全。[6]
金属配合物
1,5-环辛二烯可以与低价金属通过碳碳双键形成典型的不饱和烃配合物。配合物Ni(cod)2是制备多种Ni(0)和Ni(II)配合物的前体。金属环辛二烯配合物很具有吸引力,因为它们足够稳定可以被分离出来,稳定性通常超过类似的乙烯配合物。环辛二烯配合物的稳定性是螯合效应造成的。环辛二烯配体很容易被其他配体取代,例如膦。

M(cod)2的结构(M = Ni、Pd、Pt)
Ni(COD)2可以在环辛二烯配体存在条件下,用三乙基铝还原无水二(乙酰丙酮)合镍制得[7]:
- 1/3 [Ni(C5H7O2)2]3 + 2 COD + 2 Al(C2H5)3 → Ni(COD)2 + 2 Al(C2H5)2(C5H7O2) + C2H4 + C2H6
类似的Pt(COD)2需要用迂回的路线制备,反应中需使用环辛四烯基二锂[8]:
- Li2C8H8 + PtCl2(COD) + 3 C7H10 → [Pt(C7H10)3] + 2 LiCl + C8H8 + C8H12
- Pt(C7H10)3 + 2 COD → Pt(COD)2 + 3 C7H10
目前已有大量关于环辛二烯配合物的研究报道,其中许多发表在无机合成(Inorganic Syntheses)第25、26和28卷上。铂配合物已经使用在许多配合物的合成中:
- Pt(COD)2 + 3 C2H4 → Pt(C2H4)3 + 2 COD
环辛二烯配合物是有用的起始原料,以下反应是一个值得注意的例子:
- Ni(cod)2 + 4 CO(g)⇌{displaystyle rightleftharpoons } Ni(CO)4 + 2 COD
生成物Ni(CO)4有剧毒,因此在反应容器中生成它比直接配制更安全。其他低价金属的环辛二烯配合物包括Mo(COD)(CO)4、[RuCl2(COD)]n和Fe(COD)(CO)3。环辛二烯在Rh(I)和Ir(I)的配位化学中特别重要,例如克拉布特里催化剂和环辛二烯氯化铑二聚体。平面四边形的配合物[M(COD)2]+也是已知的(M = Rh、Ir)。
(E,E)-COD
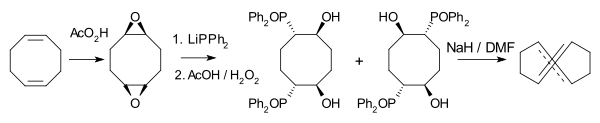
(E,E)-COD合成(斯托克曼等人,2011年)
1,5-环辛二烯张力很大的反-反异构体是一种已知的化合物。(E,E)-COD最早由乔治·怀特塞兹和阿瑟·科普在1969年通过顺式异构体的光异构化制得。[9]另一种合成路线(八元环的双消除反应)由罗尔夫·胡伊斯根于1987年报道。[10](E,E)-COD的构象是扭船式而不是椅式的。这种化合物已被研究用于点击化学的介质。[11]
参考文献
^ Buehler, C; Pearson, D.Survey of Organic Syntheses. Wiley-Intersciene, New York. 1970.
^ Shriver, D; Atkins, P.Inorganic Chemistry. W. H. Freeman and Co., New York. 1999.
^ Thomas Schiffer, Georg Oenbrink “Cyclododecatriene, Cyclooctadiene, and 4-Vinylcyclohexene” in Ullmann’s Encyclopedia of Industrial Chemistry, 2005, Wiley-VCH, Weinheim.
^ John A. Soderquist and Alvin Negron (1998). "9-Borabicyclo[3.3.1]nonane Dimer". Org. Synth.; Coll. Vol. 9: 95.
^ Roger Bishop. "9-Thiabicyclo[3.3.1nonane-2,6-dione]". Org. Synth.; Coll. Vol. 9: 692. Díaz, David Díaz; Converso, Antonella; Sharpless, K. Barry; Finn, M. G. 2,6-Dichloro-9-thiabicyclo[3.3.1]nonane: Multigram Display of Azide and Cyanide Components on a Versatile Scaffold (PDF). Molecules. 2006, 11: 212–218. doi:10.3390/11040212.
^ 宋礼成, 王佰全. 金属有机化学原理及应用. 高等教育出版社, 2012. pp 411
^ Schunn, R; Ittel, S. Bis(1,5-Cyclooctadiene) Nickel(0). Inorg. Synth. 1990, 28: 94. doi:10.1002/9780470132593.ch25.
^ Crascall, L; Spencer, J. Olefin Complexes of Platinum. Inorg. Synth. 1990, 28: 126. doi:10.1002/9780470132593.ch34.
^ Irradiation of cis,cis-1,5-cyclooctadiene in the presence of copper(I) chloride George M. Whitesides, Gerald L. Goe, Arthur C. Cope J. Am. Chem. Soc., 1969, 91 (10), pp 2608–2616 doi:10.1021/ja01038a036
^ Preparation and conformation of (E,E)-1,5-cyclooctadiene Dieter Boeckh, Rolf Huisgen, Heinrich Noeth J. Am. Chem. Soc., 1987, 109 (4), pp 1248–1249 doi:10.1021/ja00238a046
^ (E,E)-1,5-Cyclooctadiene: a small and fast click-chemistry multitalent Henning Stöckmann, André A. Neves, Henry A. Day, Shaun Stairs, Kevin M. Brindle and Finian J. Leeper Chem. Commun., 2011 doi:10.1039/C1CC12161H
| ||||||||||||||

![2,6-Dichloro-9-thiabicyclo[3.3.1]nonane, synthesis and reactions](http://upload.wikimedia.org/wikipedia/commons/thumb/a/ab/CODSCl2.png/450px-CODSCl2.png)


